MICROSCOPÍA
En general la microscopía se utiliza en microbiología para dos fines básicos: la detección inicial de microorganismos y la identificación preliminar o definitiva de los mismos. El estudio microscópico de las muestras se utiliza para detectar células bacterianas, elementos fúngicos, parásitos en sus diferentes estadios (huevos, larvas o formas adultas), así como inclusiones víricas presentes en las células infectadas. Las propiedades morfológicas características se pueden utilizar para la identificación preliminar de la mayoría de las bacterias, y para la identificación definitiva de muchos hongos y parásitos.
Históricamente, los mayores avances de la microbiología han coincidido con el desarrollo de nuevas herramientas y mejora de las tradicionales existentes para el estudio de los microorganismos. El microscopio es el instrumento más antiguo y más básico para el estudio de las estructuras microbianas. Existen muchos tipos de microscopios, y algunos de ellos son extremadamente potentes. Por tanto, como introducción de nuestro estudio de las estructuras celulares revisaremos algunas de las herramientas habituales para visualizar las células con el fin de entender cómo funcionan y qué pueden enseñarnos.
El descubrimiento de la estructura celular: el microscopio óptico
Para ver microorganismos se necesita un microscopio, ya sea óptico o electrónico. En general, los microscopios ópticos se usan para examinar células a relativamente pocos aumentos, y los electrónicos para examinar células y estructuras celulares a muchos aumentos. Todos los microscopios utilizan lentes que amplifican la imagen.
No obstante, el aumento no es el factor limitante en nuestra capacidad para ver objetos pequeños; es la resolución —la capacidad para identificar dos objetos adyacentes como distintos e independientes— lo que regula nuestra habilidad para ver lo muy pequeño. Si bien los aumentos se pueden aumentar prácticamente sin límite, con la resolución no ocurre lo mismo, ya que es una función de las propiedades físicas de la luz.
Para empezar estudiaremos el microscopio óptico, cuyo límite de resolución es, aproximadamente, de 0,2 μm (μm es la abreviatura de micrómetro, 10^−6 m). A continuación seguiremos con el microscopio electrónico, cuya resolución es considerablemente mayor.
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Aumento y resolución
El aumento total de un microscopio de luz compuesto es el producto del aumento del objetivo por el del ocular. El límite superior de los microscopios ópticos es de unos 2.000 aumentos, y a aumentos superiores la resolución no mejora. La resolución es una función de la longitud de onda de la luz utilizada, y es una característica de la lente del objetivo conocida como apertura numérica, que es una medida de la capacidad de la lente para captar la luz. Hay una correlación entre el aumento de una lente y su apertura numérica; las lentes con más aumentos normalmente tienen una apertura numérica más alta. El diámetro del objeto más pequeño que se puede distinguir con cualquier lente es igual a 0,5 λ/apertura numérica, donde λ es la longitud de onda de la luz utilizada. Esta fórmula demuestra que la resolución es máxima cuando se utiliza luz azul para iluminar la muestra (la luz azul tiene una longitud de onda más corta que la luz blanca o roja) y el objetivo tiene una apertura numérica muy grande. Como hemos dicho, la mayor resolución posible en un microscopio óptico compuesto es de unos 0,2 μm. Esto significa que dos objetos que estén a menos de 0,2 μm uno del otro no se pueden identificar como distintos e independientes. Los microscopios que se utilizan en microbiología tienen lentes oculares de 10-20 aumentos y objetivos de 10-100 aumentos. A 1.000 aumentos los objetos con un diámetro de 0,2 μm se pueden distinguir con dificultad. Con el objetivo de 100 aumentos y algunos otros de apertura numérica muy alta, se coloca un aceite de calidad óptica entre el portaobjetos del microscopio y el objetivo. Las lentes en las que se utiliza aceite se llaman lentes de inmersión en aceite. El aceite de inmersión aumenta la capacidad de una lente para captar la luz al permitir que algunos de los rayos de luz que salen de la muestra formando un ángulo (y que, de otra forma, el objetivo no captaría) sean captados y vistos.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Microscopía de campo claro (óptica): Los componentes básicos de los microscopios ópticos son una fuente de luz que se utiliza para iluminar la muestra colocada en una platina, un condensador para enfocar la luz en la muestra y dos sistemas de lentes (lente del objetivo y lente del ocular) que se utilizan para ampliar la imagen de la muestra. En la microscopía de campo claro la muestra se ve mediante transiluminación, de manera que la luz procedente del condensador atraviesa la muestra. Después se amplía la imagen, primero por la lente del objetivo y después por la lente del ocular. La ampliación total de la imagen es el producto de las ampliaciones de las lentes del objetivo y del ocular.
Habitualmente se utilizan tres lentes del objetivo diferentes: bajo aumento (aumento de 10 veces), que se puede utilizar para explorar una muestra; alto aumento en seco (40 veces), que se utiliza para buscar microorganismos grandes como parásitos y hongos filamentosos; e inmersión en aceite (100 veces), que se utiliza para observar bacterias, levaduras (fase unicelular de los hongos) y los detalles morfológicos de los microorganismos y las células de mayor tamaño. Las lentes del ocular pueden ampliar aún más la imagen (generalmente de 10 a 15 veces).
La limitación de la microscopia de campo claro es la resolución de la imagen (es decir, la capacidad de distinguir que dos objetos están separados y que no son uno solo).
La capacidad de resolución de un microscopio está determinada por la longitud de onda de la luz utilizada para iluminar el objeto y el ángulo de la luz que entra en la lente del objetivo (al que se denomina abertura numérica). La capacidad de resolución es máxima cuando se interpone aceite entre la lente del objetivo (habitualmente la lente de 100 × ) y la muestra, porque el aceite reduce la dispersión de la luz. Los mejores microscopios de campo claro tienen una capacidad de resolución de aproximadamente 0,2 mm, lo que permite ver la mayoría de las bacterias, pero no los virus. Aunque la mayoría de las bacterias y los microorganismos de mayor tamaño se pueden ver mediante microscopia de campo claro, los índices de refracción de los microorganismos y el fondo son similares.
Por tanto, los microorganismos se deben teñir con un colorante para poder observarlos, o se debe utilizar un método microscópico alternativo.
Microscopía de contraste de fases: La microscopia de contraste de fases permite examinar los detalles internos de los microorganismos. Este tipo de microscopía se basa en el principio según el cual las células tienen un índice de refracción (un factor por el cual la luz es más lenta cuando pasa a través de un material) diferente al del medio que la rodea. Así pues, la luz que atraviesa una célula tiene una fase distinta de la que atraviesa el líquido circundante. Dicho de otra manera al hacer pasar haces de luz paralelos a través de objetos de densidades diferentes, la longitud de onda de un haz se «desfasa» en relación con el otro haz de luz (es decir, el haz que atraviesa el material más denso se retrasa más que el otro). Mediante el uso de anillos anulares en el condensador y en las lentes del objetivo se amplifican las diferencias de fases, de modo que la luz en fase parece más brillante que la luz fuera de fase. Esto crea una imagen tridimensional del microorganismo o de la muestra y permite un análisis más detallado de las estructuras internas.
Microscopía de contraste por interferencia diferencial: La microscopía de contraste por interferencia diferencial (DIC, del inglés «differential interference contrast») es un tipo de microscopía óptica que utiliza un polarizador en el condensador para producir luz polarizada (luz en un solo plano). Esta luz polarizada pasa después por un prisma que genera dos haces distintos, que atraviesan la muestra y entran en el objetivo, donde se vuelven a unir en uno solo. Como los dos haces atraviesan sustancias con índices de refracción diferentes, los haces combinados no están completamente en fase, sino que interfieren entre sí, y este efecto realza las sutiles diferencias de la estructura celular. Así, con la microscopía DIC, estructuras celulares como el núcleo de las células eucariotas o las endosporas, vacuolas e inclusiones de las células bacterianas adquieren un aspecto más tridimensional. La microscopía DIC se usa normalmente con células sin teñir, ya que puede poner de manifiesto estructuras celulares internas que son prácticamente invisibles en campo claro.
Microscopia de campo oscuro: En los microscopios de campo oscuro se utilizan las mismas lentes del objetivo y del ocular que en los microscopios de campo claro; sin embargo, se utiliza un condensador especial que impide que la luz transmitida ilumine directamente la muestra. Sólo la luz oblicua y dispersa llega a la muestra y atraviesa los sistemas de las lentes, lo que hace que la muestra esté muy iluminada sobre un fondo negro. La ventaja de este método es que la capacidad de resolución de la microscopia de campo oscuro es significativamente mayor que la de la microscopia de campo claro (es decir, 0,02 mm en comparación con 0,2 mm), lo que posibilita la detección de bacterias muy delgadas, como Treponema pallidum (microorganismo causal de la sífilis) y el género Leptospira (leptospirosis). La desventaja de este método es que la luz pasa alrededor de los microorganismos y no los atraviesa, lo que dificulta el estudio de su estructura interna.
Microscopía de fluorescencia: La microscopía de fluorescencia se utiliza para visualizar muestras que emiten fluorescencia, es decir, que emiten luz de un color diferente al de la luz que han absorbido. Las células emiten fluorescencia porque contienen sustancias fluorescentes naturales, como la clorofila u otros componentes fluorescentes (autofluorescencia), o bien porque están teñidas con un colorante fluorescente. El DAPI (4',6-diamidino-2-fenilindol) es un colorante fluorescente muy usado que tiñe las células de color azul brillante porque forma complejos con el DNA. Este colorante puede utilizarse para visualizar células en sus hábitats naturales como el suelo, el agua y los alimentos, o en muestras clínicas. Por tanto, la microscopía de fluorescencia con DAPI se usa mucho para el diagnóstico clínico microbiológico, así como en ecología microbiana para contar bacterias en un ambiente natural o en una suspensión celular.
El microscopio de fluorescencia utiliza una lámpara de vapor de mercurio, de un halógeno o de xenón
a presión elevada que emite una longitud de onda de luz más corta que la que emiten los microscopios de campo claro tradicionales. Se utiliza una serie de filtros para bloquear el calor que genera la lámpara, eliminar la luz infrarroja y seleccionar la longitud de onda adecuada para excitar el fluorocromo. Posteriormente la luz que emite el fluorocromo se amplifica con las lentes del objetivo y del ocular tradicionales. Los microorganismos y las muestras teñidos con fluorocromos aparecen brillantes sobre un fondo oscuro, aunque los colores varían dependiendo del fluorocromo seleccionado. El contraste entre el microorganismo y el fondo es suficientemente grande como para que se pueda realizar una búsqueda rápida del microorganismo con bajo aumento y después el material se explora con mayor aumento, una vez que se ha detectado fluorescencia.
B) Microscopio electrónico
Los microscopios electrónicos utilizan electrones en lugar de luz visible (fotones) para generar imágenes de células y estructuras celulares. En el microscopio electrónico las lentes son electromagnéticas y todo el equipo trabaja en un sistema de vacío. Los microscopios electrónicos están equipados con cámaras para poder tomar fotografías, llamadas micrografías electrónicas. Normalmente, en microbiología se usan dos tipos de microscopio electrónico: el de transmisión y el de barrido.
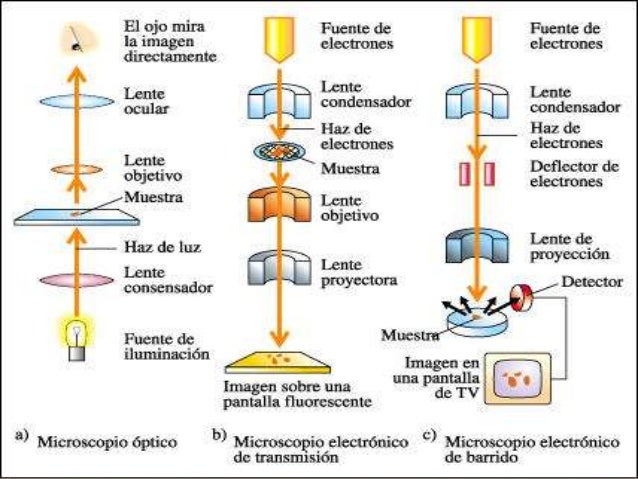
Microscopía electrónica de transmisión: El microscopio electrónico de transmisión (TEM, del inglés «transmission electron microscope») se utiliza para examinar células y estructuras celulares a muchos aumentos y gran resolución. El poder de resolución de un TEM es mucho mayor que el del microscopio óptico, y permite incluso ver estructuras a escala molecular (Figura 2.10). Esto es debido a que la longitud de onda de los electrones es mucho más corta que la de la luz visible y, como hemos visto, la longitud de onda influye en la resolución. Por ejemplo, mientras que el poder de resolución de un microscopio óptico es de unos 0,2 micrómetros, el de un TEM es de unos 0,2 nanómetros, mil veces más. Con una resolución tan potente, se pueden visualizar objetos tan pequeños como una molécula individual de proteína o de ácido nucleico. Sin embargo, a diferencia de los fotones, los electrones tienen muy poco poder de penetración; incluso una sola célula es demasiado gruesa para atravesarla con un haz de electrones. En consecuencia, para observar la estructura interna de una célula es necesario obtener secciones finas de ella, y luego estabilizarlas y teñirlas con distintos productos químicos para hacerlas visibles. Una sola célula bacteriana, por ejemplo, se divide en cortes extremadamente finos (20-60 nm), que después se examinan individualmente por TEM. Para obtener suficiente contraste, se tratan las secciones con un colorante como ácido ósmico, permanganato, o sales de uranio, lantano o plomo. Estas sustancias están compuestas por átomos de gran peso atómico que, por tanto, desvían los electrones y mejoran el contraste. Si solo interesan las características externas de un organismo no es necesario obtener secciones finas y se pueden observar directamente células o componentes celulares intactos mediante una técnica llamada tinción negativa.
Microscopía electrónica de barrido: Para obtener una imagen tridimensional óptima de una célula se utiliza el microscopio electrónico de barrido (SEM, del inglés «scanning electron microscopy»). En la microscopía electrónica de barrido, la muestra se cubre con una capa fina de un metal pesado, normalmente oro. A continuación, un haz de electrones barre una y otra vez la muestra. Los electrones son desviados por la capa de metal y recogidos y proyectados en un monitor para producir una imagen. En el microscopio electrónico de barrido se pueden observar también muestras bastante grandes, y la profundidad de campo (la porción de la imagen que queda enfocada) es extremadamente
buena. Con estos microscopios se puede obtener un amplio rango de aumentos, desde solo 15 hasta 100.000 aumentos, pero normalmente solo se visualiza la superficie del objeto.
NOTA: Las micrografías tomadas por microscopía electrónica de transmisión o de barrido son originalmente en blanco y negro. No obstante, aunque las imágenes originales contienen la máxima información científica que se puede obtener, a menudo se les añade color mediante ordenador, pero este falso color no mejora la resolución de las micrografías; su valor principal es aumentar el valor artístico de la imagen para el público de los medios de comunicación.
A) El microscopio óptico compuesto
El microscopio óptico utiliza la luz visible para iluminar las estructuras celulares. En microbiología se usan distintos tipos de microscopios ópticos: de campo claro, contraste de fases, contraste por interferencia diferencial, campo oscuro y fluorescencia.----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Aumento y resolución
El aumento total de un microscopio de luz compuesto es el producto del aumento del objetivo por el del ocular. El límite superior de los microscopios ópticos es de unos 2.000 aumentos, y a aumentos superiores la resolución no mejora. La resolución es una función de la longitud de onda de la luz utilizada, y es una característica de la lente del objetivo conocida como apertura numérica, que es una medida de la capacidad de la lente para captar la luz. Hay una correlación entre el aumento de una lente y su apertura numérica; las lentes con más aumentos normalmente tienen una apertura numérica más alta. El diámetro del objeto más pequeño que se puede distinguir con cualquier lente es igual a 0,5 λ/apertura numérica, donde λ es la longitud de onda de la luz utilizada. Esta fórmula demuestra que la resolución es máxima cuando se utiliza luz azul para iluminar la muestra (la luz azul tiene una longitud de onda más corta que la luz blanca o roja) y el objetivo tiene una apertura numérica muy grande. Como hemos dicho, la mayor resolución posible en un microscopio óptico compuesto es de unos 0,2 μm. Esto significa que dos objetos que estén a menos de 0,2 μm uno del otro no se pueden identificar como distintos e independientes. Los microscopios que se utilizan en microbiología tienen lentes oculares de 10-20 aumentos y objetivos de 10-100 aumentos. A 1.000 aumentos los objetos con un diámetro de 0,2 μm se pueden distinguir con dificultad. Con el objetivo de 100 aumentos y algunos otros de apertura numérica muy alta, se coloca un aceite de calidad óptica entre el portaobjetos del microscopio y el objetivo. Las lentes en las que se utiliza aceite se llaman lentes de inmersión en aceite. El aceite de inmersión aumenta la capacidad de una lente para captar la luz al permitir que algunos de los rayos de luz que salen de la muestra formando un ángulo (y que, de otra forma, el objetivo no captaría) sean captados y vistos.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Microscopía de campo claro (óptica): Los componentes básicos de los microscopios ópticos son una fuente de luz que se utiliza para iluminar la muestra colocada en una platina, un condensador para enfocar la luz en la muestra y dos sistemas de lentes (lente del objetivo y lente del ocular) que se utilizan para ampliar la imagen de la muestra. En la microscopía de campo claro la muestra se ve mediante transiluminación, de manera que la luz procedente del condensador atraviesa la muestra. Después se amplía la imagen, primero por la lente del objetivo y después por la lente del ocular. La ampliación total de la imagen es el producto de las ampliaciones de las lentes del objetivo y del ocular.
Habitualmente se utilizan tres lentes del objetivo diferentes: bajo aumento (aumento de 10 veces), que se puede utilizar para explorar una muestra; alto aumento en seco (40 veces), que se utiliza para buscar microorganismos grandes como parásitos y hongos filamentosos; e inmersión en aceite (100 veces), que se utiliza para observar bacterias, levaduras (fase unicelular de los hongos) y los detalles morfológicos de los microorganismos y las células de mayor tamaño. Las lentes del ocular pueden ampliar aún más la imagen (generalmente de 10 a 15 veces).
La limitación de la microscopia de campo claro es la resolución de la imagen (es decir, la capacidad de distinguir que dos objetos están separados y que no son uno solo).
La capacidad de resolución de un microscopio está determinada por la longitud de onda de la luz utilizada para iluminar el objeto y el ángulo de la luz que entra en la lente del objetivo (al que se denomina abertura numérica). La capacidad de resolución es máxima cuando se interpone aceite entre la lente del objetivo (habitualmente la lente de 100 × ) y la muestra, porque el aceite reduce la dispersión de la luz. Los mejores microscopios de campo claro tienen una capacidad de resolución de aproximadamente 0,2 mm, lo que permite ver la mayoría de las bacterias, pero no los virus. Aunque la mayoría de las bacterias y los microorganismos de mayor tamaño se pueden ver mediante microscopia de campo claro, los índices de refracción de los microorganismos y el fondo son similares.
Por tanto, los microorganismos se deben teñir con un colorante para poder observarlos, o se debe utilizar un método microscópico alternativo.
Microscopía de contraste de fases: La microscopia de contraste de fases permite examinar los detalles internos de los microorganismos. Este tipo de microscopía se basa en el principio según el cual las células tienen un índice de refracción (un factor por el cual la luz es más lenta cuando pasa a través de un material) diferente al del medio que la rodea. Así pues, la luz que atraviesa una célula tiene una fase distinta de la que atraviesa el líquido circundante. Dicho de otra manera al hacer pasar haces de luz paralelos a través de objetos de densidades diferentes, la longitud de onda de un haz se «desfasa» en relación con el otro haz de luz (es decir, el haz que atraviesa el material más denso se retrasa más que el otro). Mediante el uso de anillos anulares en el condensador y en las lentes del objetivo se amplifican las diferencias de fases, de modo que la luz en fase parece más brillante que la luz fuera de fase. Esto crea una imagen tridimensional del microorganismo o de la muestra y permite un análisis más detallado de las estructuras internas.
Microscopía de contraste por interferencia diferencial: La microscopía de contraste por interferencia diferencial (DIC, del inglés «differential interference contrast») es un tipo de microscopía óptica que utiliza un polarizador en el condensador para producir luz polarizada (luz en un solo plano). Esta luz polarizada pasa después por un prisma que genera dos haces distintos, que atraviesan la muestra y entran en el objetivo, donde se vuelven a unir en uno solo. Como los dos haces atraviesan sustancias con índices de refracción diferentes, los haces combinados no están completamente en fase, sino que interfieren entre sí, y este efecto realza las sutiles diferencias de la estructura celular. Así, con la microscopía DIC, estructuras celulares como el núcleo de las células eucariotas o las endosporas, vacuolas e inclusiones de las células bacterianas adquieren un aspecto más tridimensional. La microscopía DIC se usa normalmente con células sin teñir, ya que puede poner de manifiesto estructuras celulares internas que son prácticamente invisibles en campo claro.
Microscopia de campo oscuro: En los microscopios de campo oscuro se utilizan las mismas lentes del objetivo y del ocular que en los microscopios de campo claro; sin embargo, se utiliza un condensador especial que impide que la luz transmitida ilumine directamente la muestra. Sólo la luz oblicua y dispersa llega a la muestra y atraviesa los sistemas de las lentes, lo que hace que la muestra esté muy iluminada sobre un fondo negro. La ventaja de este método es que la capacidad de resolución de la microscopia de campo oscuro es significativamente mayor que la de la microscopia de campo claro (es decir, 0,02 mm en comparación con 0,2 mm), lo que posibilita la detección de bacterias muy delgadas, como Treponema pallidum (microorganismo causal de la sífilis) y el género Leptospira (leptospirosis). La desventaja de este método es que la luz pasa alrededor de los microorganismos y no los atraviesa, lo que dificulta el estudio de su estructura interna.
Microscopía de fluorescencia: La microscopía de fluorescencia se utiliza para visualizar muestras que emiten fluorescencia, es decir, que emiten luz de un color diferente al de la luz que han absorbido. Las células emiten fluorescencia porque contienen sustancias fluorescentes naturales, como la clorofila u otros componentes fluorescentes (autofluorescencia), o bien porque están teñidas con un colorante fluorescente. El DAPI (4',6-diamidino-2-fenilindol) es un colorante fluorescente muy usado que tiñe las células de color azul brillante porque forma complejos con el DNA. Este colorante puede utilizarse para visualizar células en sus hábitats naturales como el suelo, el agua y los alimentos, o en muestras clínicas. Por tanto, la microscopía de fluorescencia con DAPI se usa mucho para el diagnóstico clínico microbiológico, así como en ecología microbiana para contar bacterias en un ambiente natural o en una suspensión celular.
El microscopio de fluorescencia utiliza una lámpara de vapor de mercurio, de un halógeno o de xenón
a presión elevada que emite una longitud de onda de luz más corta que la que emiten los microscopios de campo claro tradicionales. Se utiliza una serie de filtros para bloquear el calor que genera la lámpara, eliminar la luz infrarroja y seleccionar la longitud de onda adecuada para excitar el fluorocromo. Posteriormente la luz que emite el fluorocromo se amplifica con las lentes del objetivo y del ocular tradicionales. Los microorganismos y las muestras teñidos con fluorocromos aparecen brillantes sobre un fondo oscuro, aunque los colores varían dependiendo del fluorocromo seleccionado. El contraste entre el microorganismo y el fondo es suficientemente grande como para que se pueda realizar una búsqueda rápida del microorganismo con bajo aumento y después el material se explora con mayor aumento, una vez que se ha detectado fluorescencia.
B) Microscopio electrónico
Los microscopios electrónicos utilizan electrones en lugar de luz visible (fotones) para generar imágenes de células y estructuras celulares. En el microscopio electrónico las lentes son electromagnéticas y todo el equipo trabaja en un sistema de vacío. Los microscopios electrónicos están equipados con cámaras para poder tomar fotografías, llamadas micrografías electrónicas. Normalmente, en microbiología se usan dos tipos de microscopio electrónico: el de transmisión y el de barrido.

Microscopía electrónica de transmisión: El microscopio electrónico de transmisión (TEM, del inglés «transmission electron microscope») se utiliza para examinar células y estructuras celulares a muchos aumentos y gran resolución. El poder de resolución de un TEM es mucho mayor que el del microscopio óptico, y permite incluso ver estructuras a escala molecular (Figura 2.10). Esto es debido a que la longitud de onda de los electrones es mucho más corta que la de la luz visible y, como hemos visto, la longitud de onda influye en la resolución. Por ejemplo, mientras que el poder de resolución de un microscopio óptico es de unos 0,2 micrómetros, el de un TEM es de unos 0,2 nanómetros, mil veces más. Con una resolución tan potente, se pueden visualizar objetos tan pequeños como una molécula individual de proteína o de ácido nucleico. Sin embargo, a diferencia de los fotones, los electrones tienen muy poco poder de penetración; incluso una sola célula es demasiado gruesa para atravesarla con un haz de electrones. En consecuencia, para observar la estructura interna de una célula es necesario obtener secciones finas de ella, y luego estabilizarlas y teñirlas con distintos productos químicos para hacerlas visibles. Una sola célula bacteriana, por ejemplo, se divide en cortes extremadamente finos (20-60 nm), que después se examinan individualmente por TEM. Para obtener suficiente contraste, se tratan las secciones con un colorante como ácido ósmico, permanganato, o sales de uranio, lantano o plomo. Estas sustancias están compuestas por átomos de gran peso atómico que, por tanto, desvían los electrones y mejoran el contraste. Si solo interesan las características externas de un organismo no es necesario obtener secciones finas y se pueden observar directamente células o componentes celulares intactos mediante una técnica llamada tinción negativa.
Microscopía electrónica de barrido: Para obtener una imagen tridimensional óptima de una célula se utiliza el microscopio electrónico de barrido (SEM, del inglés «scanning electron microscopy»). En la microscopía electrónica de barrido, la muestra se cubre con una capa fina de un metal pesado, normalmente oro. A continuación, un haz de electrones barre una y otra vez la muestra. Los electrones son desviados por la capa de metal y recogidos y proyectados en un monitor para producir una imagen. En el microscopio electrónico de barrido se pueden observar también muestras bastante grandes, y la profundidad de campo (la porción de la imagen que queda enfocada) es extremadamente
buena. Con estos microscopios se puede obtener un amplio rango de aumentos, desde solo 15 hasta 100.000 aumentos, pero normalmente solo se visualiza la superficie del objeto.
NOTA: Las micrografías tomadas por microscopía electrónica de transmisión o de barrido son originalmente en blanco y negro. No obstante, aunque las imágenes originales contienen la máxima información científica que se puede obtener, a menudo se les añade color mediante ordenador, pero este falso color no mejora la resolución de las micrografías; su valor principal es aumentar el valor artístico de la imagen para el público de los medios de comunicación.

Comentarios
Publicar un comentario